随着社会经济的发展、居民生活水平的提高以及生活方式的改变, 糖尿病患病率明显升高,其中2型糖尿病(T2DM)占糖尿病患者90%以上,其主要特征表现为胰岛素抵抗(IR)、胰岛β 细胞功能障碍和胰岛素代谢改变。
IR是指胰岛素的靶器官或靶组织 (主要是肝脏、骨骼肌和脂肪组织) 对胰岛素的敏感性及反应性降低,导致正常剂量的胰岛素所产生的生物学效应低于正常的一种病理状态。有学者发现胰岛素降解速度加快可能是导致IR的原因之一,而抑制胰岛素的过快降解可以一定程度改善IR。
胰岛素降解广泛存在于多种器官和组织,这一功能主要由胰岛素降解酶(IDE) 来实现。研究表明,在以IR为重要发病机制的T2DM、代谢综合征等患者中IDE活性显著高于正常人。在以IDE为靶点治疗糖尿病时需要兼顾抑制胰岛素的降解和不影响胰高血糖素的降解两方面,这就使得针对IDE的选择性抑制剂(SSI)的研究成为必然,以期优先抑制胰岛素的降解,而不妨碍胰高血糖素的降解。
在过去十多年的研究中,出现了两种不同的IDE抑制剂。一种是传统的金属蛋白酶抑制剂,如Ii1,它是利用锌离子螯合剂直接干扰Zn2+结合部位来抑制酶活性,但是其并没有选择性的仅抑制IDE对胰岛素的作用;另一种新发现的抑制剂,如6bK,是通过结合在催化活性位点相邻的“外位点”结合口袋处,占据底物结合部位而竞争性抑制IDE活性的,原则上,这种“外位点”抑制剂或许可以通过底物选择性而维持IDE某些蛋白水解活性,但是其可能性还未可知。
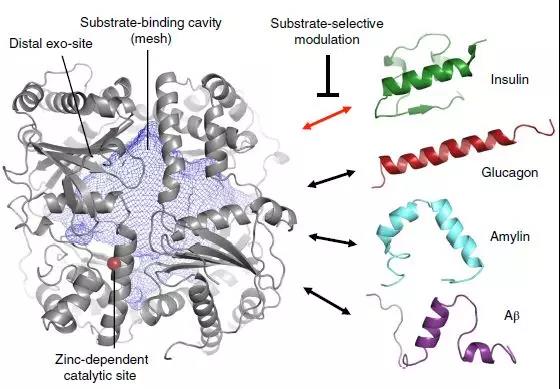
胰岛素降解酶(IDE)的分子结构
迄今为止,SSI并未被系统的应用于治疗的研究中,其结构基础仍是未知数,基于此,近日,NatureChemical Biology上发表题为Substrate-selective inhibitors that reprogram the activity of insulin-degrading enzyme的文章,结合生物化学、小分子筛选、药物化学和结构生物学多领域发现并描绘了一系列有效且独特的药物分子,其可以通过底物选择性而特异性地抑制IDE对胰岛素的蛋白水解活性,并揭示其分子基础,为靶向IDE的治疗手段提供新思路,也为其他类似蛋白酶的底物选择性研究提供了方向。

首先,研究人员采用一个非活性位点配体的高通量筛选,发现了一系列新的IDE“外位点”结合配体,接着他们利用结合了荧光耦合单克隆抗体的均相时间分辨能量共振转移(HTRF)技术,在这些新配体中发现了两个配体Compound 5和Compound 6可以选择性地抑制IDE对胰岛素的降解作用,且这种作用是剂量依赖性的,而其几乎不影响IDE对胰高血糖素、胰淀素和Aβ40的作用,称为第二代IDE抑制剂。
随后,在第二代IDE抑制剂Compound 5的基础上,研究人员对其分子结构进行改造,以期优化其底物选择性的能力,通过依次改变联芳环取代基、吖丁啶融合大环连接键和磺胺取代基,最终确定第三代IDE“外位点”抑制剂37和63,其表现出更有效的选择性抑制胰岛素降解的作用,而不影响胰高血糖素的降解,即使是在抑制剂浓度饱和的情况下也仍旧维持着这种底物选择性。
最后,为了阐明底物选择性IDE抑制剂的分子基础,研究者们分别在2.96 ? 和3.49? 分辨率下解析IDE与SSI 37和63的X-射线晶体结构,同时在3.18?的分辨率下解析了IDE-63-胰高血糖素三元复合物的X-射线晶体结构,从而揭示了SSI改造IDE底物识别机制的独特能力,这种能力来源于底物特异性的空间差异,SSI竞争性地将胰岛素从IDE上的结合位点——外位点区域剔除,而小且灵活的底物如胰高血糖素仍然可以与IDE的催化中心结合,同时SSI的外位点结合口袋处与催化中心的距离超过16 ?,以至于SSI的部分非竞争性抑制作用也不会影响胰高血糖素的结合。
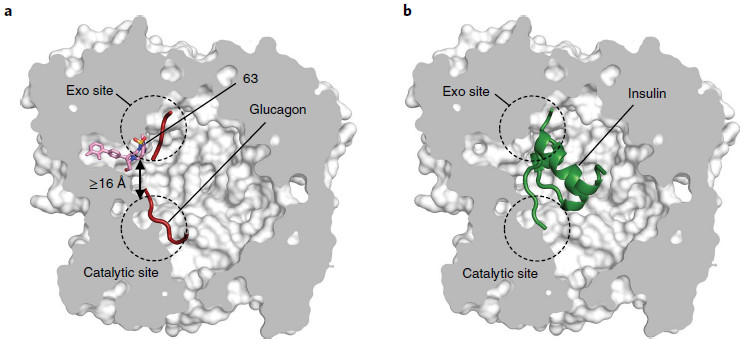
a. IDE-63-胰高血糖素三元复合物的X-射线晶体结构
b. IDE-胰岛素结合的X-射线晶体结构
综上所述,SSI使得抑制IDE降解胰岛素作用的同时胰高血糖素和其他底物几乎不受影响,且在各种浓度下均呈现出较高的底物选择性抑制作用,在抑制胰岛素与IDE“外位点”结合的同时也能通过催化位点的结合形成IDE-SSI-胰高血糖素三元复合体,从而有别于传统的构象抑制剂。此外,由于“外位点”独特存在于IDE中,这就避免了SSI脱靶于其他Zn2+依赖的金属蛋白酶,从而开启了靶向IDE治疗2型糖尿病的可能性。
