新闻资讯
NEWS
行业资讯
NEWS
 Crisaborole API & Intermedia…
Crisaborole API & Intermedia…  Topiroxostat API & Intermedi…
Topiroxostat API & Intermedi…  Tavaborole API & Intermedia…
Tavaborole API & Intermedia…  Upadacitinib API & Intermed…
Upadacitinib API & Intermed…  BrexpiprazoleAPI & Intermedi…
BrexpiprazoleAPI & Intermedi…  TEST
TEST  Others
Others  Ticagrelor Intermediates
Ticagrelor Intermediates  Others
Others  Parecoxib sodium Intermediat…
Parecoxib sodium Intermediat…  Canagliflozin Intermediates
Canagliflozin Intermediates  Empagliflozin Intermediates
Empagliflozin Intermediates  Dapagliflozin Intermediates
Dapagliflozin Intermediates  Tofacitinib Intermediates
Tofacitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Vonoprazan Fumarate Intermed…
Vonoprazan Fumarate Intermed…  Febuxostat Intermediates
Febuxostat Intermediates  Ceftaroline fosamil Interme…
Ceftaroline fosamil Interme…  Rivaroxaban Intermediates
Rivaroxaban Intermediates  Avatrombopag Intermediates
Avatrombopag Intermediates  Ramelteon Intermediates
Ramelteon Intermediates  Pimavanserin Intermediates
Pimavanserin Intermediates  Intermediates of Carbapenems…
Intermediates of Carbapenems…  Dabigatran etexilate Interme…
Dabigatran etexilate Interme…  Crisaborole Intermediates
Crisaborole Intermediates  Finafloxacin Hydrochloride I…
Finafloxacin Hydrochloride I…  Meropenem
Meropenem  Sacubitril
Sacubitril  Apixaban Intermediates
Apixaban Intermediates  Zolpidem tartrater Intermedi…
Zolpidem tartrater Intermedi…  Tolvaptan Intermediates
Tolvaptan Intermediates  Edoxaban Intermediates
Edoxaban Intermediates  Nucleus and intermediates of…
Nucleus and intermediates of…  Acotiamide intermediates
Acotiamide intermediates  Apremilast intermediates
Apremilast intermediates  Roxadustat intermediates
Roxadustat intermediates  Linagliptin intermediates
Linagliptin intermediates  Ibrutinib Intermediates
Ibrutinib Intermediates  Eltrombopag Intermediates
Eltrombopag Intermediates  Posaconazole Intermediates
Posaconazole Intermediates 一、东阳光启动头对头:
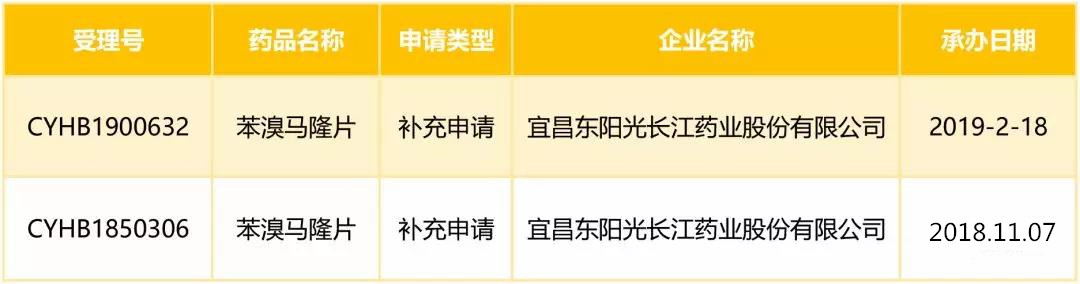
2018年度,东阳光药年报披露苯溴马隆销售额为9870万元。近期,东阳光启动了苯溴马隆4期与非布司他头对头临床。此次PK,可能是为了痛风市场销售,学术营销等等。本产品仿制药BE已经在2018年6月完成,登记号CTR20180508,并提交一致性补充申请。早前,登记号为CTR20170317选择参比制剂与药监局披露不同。

二、国内概况:
痛风/高尿酸血症,庞大市场。目前在最新2017年版《国家医保药品目录》中有5款相关品种,分别是非布司他、苯溴马隆、别嘌醇、秋水仙碱和丙磺舒。每个药各有利弊。
1.目前国内市场中,非布司他份额最大,其次是苯溴马隆。
2.米内数据显示,苯溴马隆国内市场份额,Excella生产的立加利仙(龙灯瑞迪进口包装)占据65.02%,合资昆山龙灯瑞迪的立加利仙占据21.75%,宜昌东阳光长江药业的尔同舒占据7.46%,常州康普药业的尤诺占据4.91%,成都泰合健康科技集团华神制药厂的迈珑占据0.86%。2017年国内苯溴马隆用药金额为3.91亿元。(2018年度,东阳光披露苯溴马隆销售额为9870万元。)
3.2017年国内重点城市公立医院非布司他销售额已超过1.2亿元(样本数据),江苏万邦占据59.07%,江苏恒瑞占据25.58%,杭州朱养心占据15.36%。
一致性补充申请或新递交的企业有:扬子江、华世通、朱养心、恒瑞等。
三、原研在2018年9月才在我国获批:
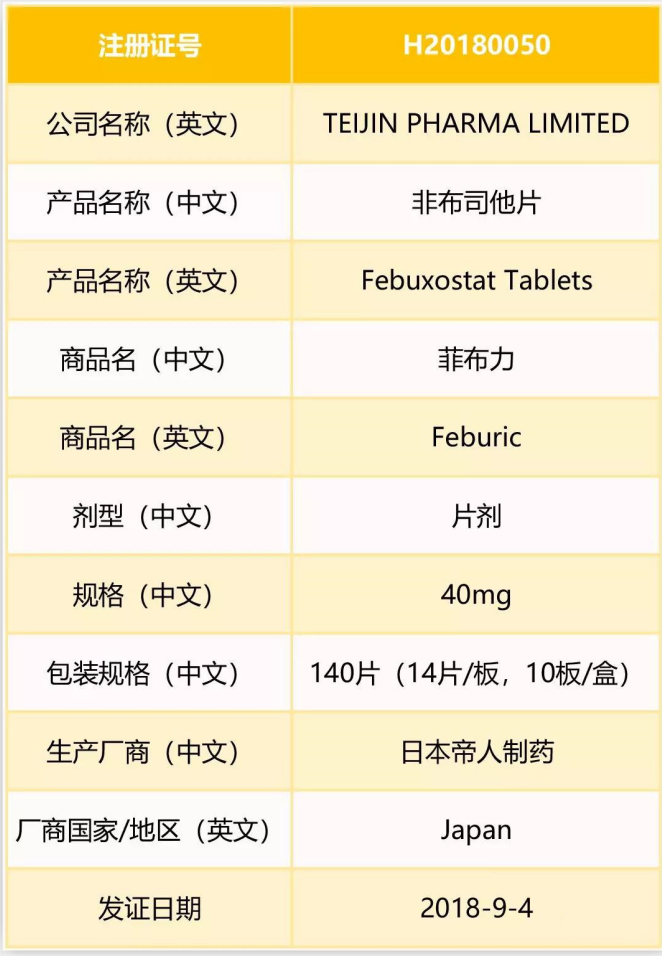
1.除40mg外,另外还有20mg规格获批上市。
2. 本品适应症:痛风,痛风性关节炎,老年人痛风,高尿酸血症,假痛风性关节炎,痛风石,遗传性高尿酸血症。
3. 药理毒理:非布佐司他是黄嘌呤氧化酶(XO)抑制剂,通过减少血清尿酸达到疗效。
4. 用法用量: 非布司他片的口服推荐剂量为40mg或80mg.每日一次。推荐非布司他片的起始剂量为40mg.每日一次.如果2周后.血尿酸水平仍不低于6mg/dl(约360μmol/L).建议剂量增至80mg.每日一次。

5. 非布司他,又称非布佐司他、非布索坦,是由日本帝人制药研发,于2004年年初在日本申请上市,随后在美国、欧洲也陆续上市。
6. 2016年,原研销售额为6.33亿美元,比上一年增长7.70%。非布司他片2017年美国市场销售额约5.4亿美元。
四、药物警戒:
2018年2月,NMPA(国家药监局)发布的药物警戒快讯 2018年第1期(总第177期),原文如下:
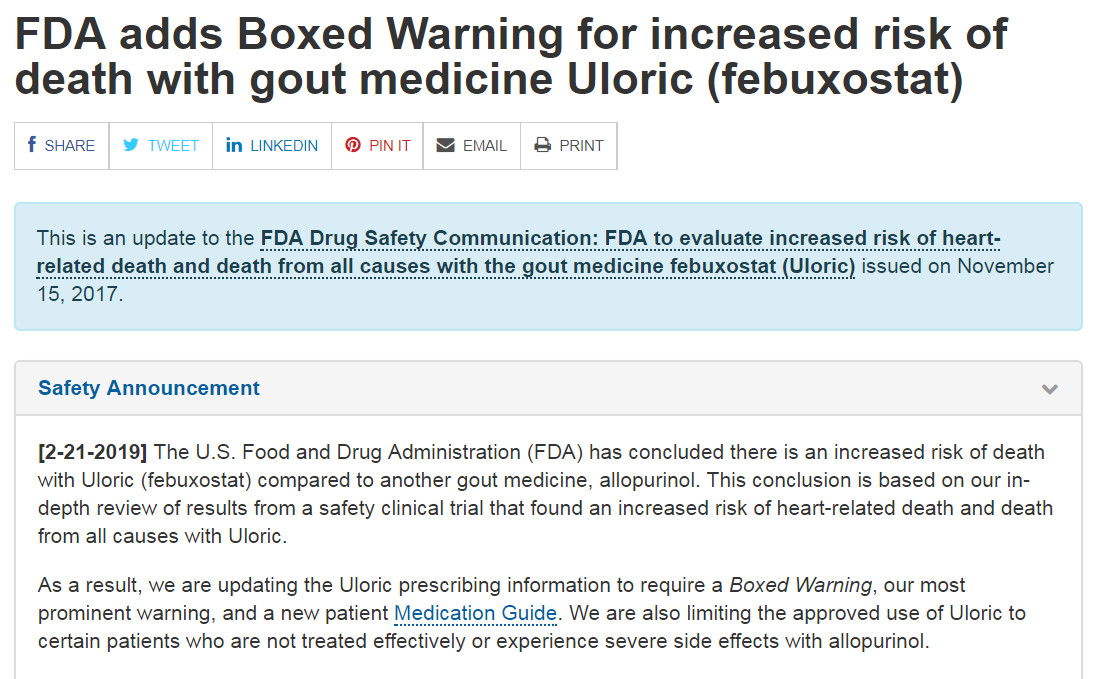
美国警告非布司他心脏相关性死亡风险
2017年11月15日,美国食品药品管理局(FDA)发布安全性警示公告称,一项安全性临床试验的初步结果表明,与别嘌醇相比,抗痛风药非布司他(febuxostat,商品名Uloric)可能增加心脏相关性死亡的风险。FDA在2009年批准该药物时,已要求非布司他的生产商武田制药公司开展安全性研究,一旦收到生产商的最终研究结果,FDA将进行全面的审评。
非布司他是FDA批准用于成年人治疗痛风的药品。痛风是体内尿酸物质堆积在一个或多个关节,并出现急性红肿、胀痛症状的疾病。非布司他通过降低血液中尿酸水平来发挥作用。
非布司他的药品说明书中已经包含了一个关于心血管事件的“警告和注意事项”,这是由于上市前临床试验发现非布司他与别嘌醇相比其心脏事件发生率增高,包括心脏病发作、中风和与心脏相关性死亡。因此,在批准该药上市后,FDA要求进行额外的安全性临床试验,以便更好地了解两药之间存在的风险差异,该试验最近已经完成。
试验是基于使用非布司他或别嘌呤醇治疗痛风的6000例患者开展的。主要终点是心脏相关性死亡、非致命性心脏病发作、非致命性中风以及需要紧急手术的心脏供血不足的情况。初步研究结果表明,非布司他与别嘌呤醇相比,总体未增加这些复合事件的发生风险,然而,当对终点分别进行评估时,非布司他显示心脏相关性死亡和全因死亡的风险增加。FDA建议医务人员在决定是否给患者处方或继续使用非布司他时应考虑此安全性信息;建议患者有任何问题或顾虑向医务人员咨询,在没有咨询医生前不要停止使用药品。FDA将继续评估此安全性问题,并更新安全性警示公告。
2019年2月21日,美国FDA正式发布针对痛风药物非布司他的警告,在深入回顾一项临床试验后,FDA 发现非布司他易增加与心脏相关的死亡风险。
转载药融数据
Copyright Bayeebio Biotech (Shanghai) Co., Ltd. Shanghai 沪ICP备16015574号

