新闻资讯
NEWS
行业资讯
NEWS
 Crisaborole API & Intermedia…
Crisaborole API & Intermedia…  Topiroxostat API & Intermedi…
Topiroxostat API & Intermedi…  Tavaborole API & Intermedia…
Tavaborole API & Intermedia…  Upadacitinib API & Intermed…
Upadacitinib API & Intermed…  BrexpiprazoleAPI & Intermedi…
BrexpiprazoleAPI & Intermedi…  TEST
TEST  Others
Others  Ticagrelor Intermediates
Ticagrelor Intermediates  Others
Others  Parecoxib sodium Intermediat…
Parecoxib sodium Intermediat…  Canagliflozin Intermediates
Canagliflozin Intermediates  Empagliflozin Intermediates
Empagliflozin Intermediates  Dapagliflozin Intermediates
Dapagliflozin Intermediates  Tofacitinib Intermediates
Tofacitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Baricitinib Intermediates
Baricitinib Intermediates  Vonoprazan Fumarate Intermed…
Vonoprazan Fumarate Intermed…  Febuxostat Intermediates
Febuxostat Intermediates  Ceftaroline fosamil Interme…
Ceftaroline fosamil Interme…  Rivaroxaban Intermediates
Rivaroxaban Intermediates  Avatrombopag Intermediates
Avatrombopag Intermediates  Ramelteon Intermediates
Ramelteon Intermediates  Pimavanserin Intermediates
Pimavanserin Intermediates  Intermediates of Carbapenems…
Intermediates of Carbapenems…  Dabigatran etexilate Interme…
Dabigatran etexilate Interme…  Crisaborole Intermediates
Crisaborole Intermediates  Finafloxacin Hydrochloride I…
Finafloxacin Hydrochloride I…  Meropenem
Meropenem  Sacubitril
Sacubitril  Apixaban Intermediates
Apixaban Intermediates  Zolpidem tartrater Intermedi…
Zolpidem tartrater Intermedi…  Tolvaptan Intermediates
Tolvaptan Intermediates  Edoxaban Intermediates
Edoxaban Intermediates  Nucleus and intermediates of…
Nucleus and intermediates of…  Acotiamide intermediates
Acotiamide intermediates  Apremilast intermediates
Apremilast intermediates  Roxadustat intermediates
Roxadustat intermediates  Linagliptin intermediates
Linagliptin intermediates  Ibrutinib Intermediates
Ibrutinib Intermediates  Eltrombopag Intermediates
Eltrombopag Intermediates  Posaconazole Intermediates
Posaconazole Intermediates
朋友圈已经有人开始怀疑:4+7带量采购或许只是药价下降的开始,以后仿制药企业会大量消失,百万仿制药从业者该何去何从?或许这一问题值得广大从业者深思,但仿制药依然大有可为,切莫过于悲观。在昨天的文章(4+7带量采购只是降价的开始:抱怨没用,我们要想办法活下去)中,笔者已经提到,虽然仿制药价格下降是国际大趋势,但笔者同样提到仿制药依然大有可为。有句名言这样说:生活从来不缺少美,缺少的永远是审美的眼睛。今天笔者就接着昨天的文章聊聊如何去发现仿制药的“美”。
认清形势,明确规划,积极应战
仿制药的机会依然很多,我们切勿过于悲观,要积极应战,做好战略布局。之前笔者研究过,中国的医药市场已经严重偏离理性,药品生产与研发一直以市场需求为导向,卖的最好的、最受热捧的品种,大多都是辅助性用药。笔者使用IMS数据库进行过分析,FDA、PMDA、EMA和欧洲发达国家批准的1600个新分子实体在中国的销售额占比只有50%,其它产品均为中国特色的产品。因此诱导中国医药市场的转型,对于政策制定者而言,或许已经迫在眉睫。
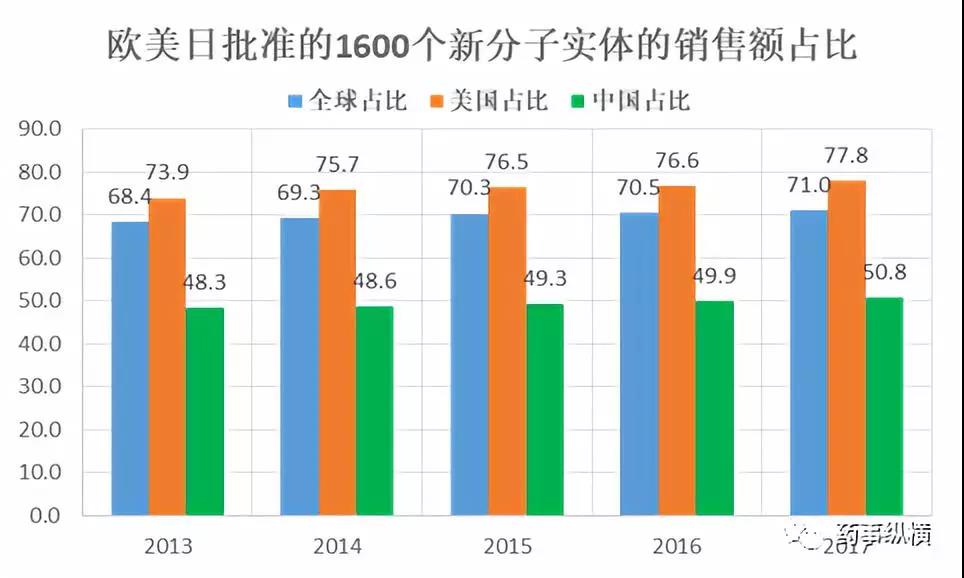
针对近年来的医改,笔者认为主要围绕这三点进行:1)解决药品短缺,控制医疗支出,解决看病难看病贵的问题;2)促进药品生产从“市场需求为导向”到“临床需求为导向”的转型;3)医疗保障机制正在“从无到有”向“从有到优”的方向转变。笔者认为只要把握住这三点,大方向就不会走错。首先,我们要做有临床需求、不可替代的品种,不论这些产品是多么冷门、销量多差,前景都是非常光明的,比如氢氯噻嗪、地西泮、多巴丝肼等。另外,随着我国经济的高速发展,近年来医保预算也有了明显的增加,在2017年的新医保目录中出现了大量专利未到期的高价原研药,而2018年的新基药目录中,还出现了索非布韦复方(Harvoni)的身影,这些迹象表明,中国的医疗保障正在从“从无到有”到“从有到优”转变。因此我们布局之时,可把有临床优势的缓控释制剂、辅助治疗药物、二线治疗药物考虑在内(此辅助性药物非彼辅助性用药,是获得FDA批准用于并发症治疗或辅助治疗的药物,如PD用药匹莫范色林、沙非酰胺,癫痫用药布瓦西坦等)。
建立完善的原料供应线
笔者之前写过武田、Watson、Teva、Celegene、Gilead等非化工企业转型的制药巨头的发家史,它们在企业做大之前,都会收购一个或者多个API生产厂,可想而知,原料的重要性。
仿制药离不开价格战,而原料药是生产成本的核心,质优价廉的原料药,可以让企业在竞争中保持不败的地位。只有拥有原料的厂家才能够保证原料低价、高质地持续供应,也才能通过不断优化原料工艺来降低生产成本或提高原料的质量。相反,没有原料的厂家,不但原料的供应方面得不到保障,很多商业行为还可能受到约束。很多时候,原料就如同风筝上的线,而控线的人就是原料生产企业,它不但会限制你飞行的高度,还有可能是“成也萧何败萧何”。
建立原料生产线的意义

没有原料生产厂,一个很好的项目可能因市售原料不合产品需求或者买不到理想的原料而流产,也可能原料药经销商层层加价,让你制剂开发所用的原料预算就远超过该原料开发成本,还可能在ANDA获批之后,原料突然坐地起价,或者原料质量出现问题,让你上市的产品被迫召回……商业竞争瞬息万变,谁也说不准原料供应企业在某一天被突然被恶意收购,或者原料来源因为被垄断而突然涨价或因质量的问题而突然断供……总而言之,这一切没有原料的风险,都应该提前预想到。
重视口碑和商标的价值
因为一致性评价和国家带量采购的原因,仿制药或许不需要做学术了,产品的流通成本有望大幅下降,在保障利润的基础上,我们可以拿节省下的营销成本用作产业链升级,改良生产设备和优化生产工艺,降低生产成本,引入人工智能,降低生产过程中的人力成本损耗。
只有药品的成本足够低,价格战中才有制胜的把握,但除了成本,商标和口碑也将是制胜的关键。在一致性评价之后,仿制药量效一致,基本可以相互替换使用,然而仿制药因为没有商品名,唯一能够区分产品特征的就是商标了,因此我们要积极培育商标的价值,仔细设计设计产品的外观和包装,要从药品外观上体现出企业的工艺水平,让医生有信心开我们的药,让患者有信心吃我们的药。
至于如何培育商标的知名度,我们可以考虑学习OTC和保健品,也可以参考香烟产业。虽然处方药不能在大众媒体上做广告,但商标可以,企业可以,我们可以通过宣传增加企业的知名度,来换取患者选择我们药品的信心。当然了,打铁还要考自身硬,光靠宣传还不行,还要做好产品质量,做好外观设计,这样才能赢得大众的口碑。拜耳的阿司匹林已经卖了100年了,尽管其他的乙酰水杨酸也叫阿司匹林,但我们还是首选拜耳的,这种口碑的商业价值,或许做销售的人再清楚不过。
强强合并,建立产业联盟共同对抗竞争
在《药品价格竞争与专利期补偿法》实施之前,仿制药也需要做完整的临床试验。因此该法案的实施可以说是开启了仿制药的新纪元。在80年代后期,美国的仿制药竞争压力并不大,从事仿制药开发的大多是北美的中小企业。但是随着仿制药在美国渐渐地斩头露角,鱼缸里的鱼瞬间多了起来。很多仿制药企业为了赢得产品的竞争优势,开始收购竞争对手,以获得某个或某几个产品的独家销售权。90年代以后,Teva,Watson,Mylan等代表性企业开始做大,他们开始疯狂地并购与自己规模相当或者比自己规模稍小的仿制药企业来增加ANDA批文数量,扩大“影响范围”,就像“贪吃蛇”一样,渐渐地吃成了“巨无霸”。
并购是以最快速度增加ANDA批文数量的一种有效方式。根据笔者掌握的数据,如果抛开首仿药不谈,一个普通的ANDA批文,年销售额一般也就几百万到几千万美元,如按这个比例计算,年销售额超过10亿美元的仿制药公司,手里至少要有100个以上的ANDA批文,而100个ANDA批文对一个中国企业而言,不走收购之路,在十年内基本不可能实现。
除了并购,我们还可以选择合并。简单而言,合并是就是“单干模式”转变为合伙人模式,让大家一起承担风险。合并是强强联手,取长补短,不但可以最快速度增加企业规模,增加话语权,获得竞争优势,而且可以剥离重复资源,降低运营成本。30年前日本的制药行业与当下中国非常相似,中小企业众多,行业混乱,乱改剂型,但自日本加入ICH和一致性评价以来,日本的制药企业发生了天翻地覆的变化,在涅槃之中,很多中小企业迎难而上,最终发展成为全球前50强制药企业,比如安斯泰来、大冢、武田、第一三共、田边三菱、协和发酵麒麟、卫材、中外等等。日本之所以在很短时间内能够产生如此多的世界制药“名企”,一方面是Mee Too出海战略的成功,另一方面是强强合并的功劳,甚至很多企业一看名字就可以知道是强强合并而成的,比如安斯泰来、第一三共、田边三菱等等,日本的制药行业发展之路与中国相比,有非常高的相似性,为什么国人不能参考日本?
俗话说出水楼台先得月,率先走出这一步的人,将率先获得优势资源。经过产业链的洗牌,人才和资源必将会一边倒,大企业可能越大,小企业可能越小,而且随着中国因加入ICH而医药市场的逐渐放开,国际仿制药巨头可能很快就涌进来了,以后的价格战将会非常激烈。现在不合并,不迅速扩大自己的规模,拿什么与欧美仿制药巨头对抗?理想的合并对象是有限的,如果不率先走出这一步,一旦被竞争对手合并或收购,无疑是增加竞争。除此之外,只有强强合并才能集中优势资源,把研发做好做强。
组建专利团队,布局首仿药
在美国,原研药专利到期之前,FDA会“tentative”批准几个,甚至十几个ANDA,这些ANDA药品可以提前放上货架,在原研药专利到期当天就可以立即销售,而且享受180天的市场独占期,如果是独家享受180天独占期(如挑战专利上市),将获得丰厚的回报。一般情况下,独家首仿药的定价可高达原研的70%,甚至更高,经过6个月的冲击,部分仿制药甚至可以瓜分掉原研30%-70%的市场,对于特大品种而言,180天卖几亿美元还是可能的。但是这180天一过,大量的仿制药上市,价格战随即就打响了,有的产品价格甚至降到原研品的10%以下。价格太低,生产成本较高的仿制药也没多少利润,很多厂家甚至就放弃了。
虽然目前中国的市场独占期制度还没有出台,但相信也快了。为了独家享受这个市场独占期,你必须挑战专利,而既然要挑战专利,你必须有一个强大的专利团队,提前布局,提前研究挑战的目标和挑战的可行性。
加入制药全球化的大流,积极国际化
在经济全球化,制药全球化的时代大背景下,我们不能再关起门来做药,否则将被困死在井底。反之,我们有必要放眼世界,其它国家经验、技术和产品我们应该及时的引进来。早在100多年前就有人提出“师夷长技以自强”、“师夷长技以制夷”的口号,这些口号在当今,在制药领域同样适用。
我国的制药行业起步晚、水准低,很多产品仍不能通过一致性评价,更别说创新制剂、biosimilar与欧美并驾齐驱了,但我国有临床需求。有需求就有市场,没有能力自己搞不要紧,我们可以巧妙地借用他人的资源,引进国外的先机技术、产品和和经验,有望助力我们实现弯道超车,虽然这其中有种种艰难险阻,但为了我们的未来,该出手时必须要出手。
在“引进”的同时,我们还要放眼世界,积极“出海”。虽说中国是全球第二大医药市场,但相比全球市场,中国仅占12%左右,中国制药企业想要真正地做大做强,必须出海。目前CFDA已经加入ICH,这为我国的制药企业出海提供了便利,与此同时,FDA一直在致力推行仿制药全球一体化,对我们而言,是挑战也是机遇。挑战是标准要提高——达到国际标准,机遇是中国批准的仿制药有望在美国、欧洲、日本等发达国家同步上市,这将为我们节省大量的开发成本,而我们要做的就是把质量做到最高、成本做到最低,以赢得竞争优势。
除此以外,我们不能把出海战略的全部目标都放在发达国家,尤其是美国和欧洲,全球还有很多发展中国家,他们的仿制药需求大,人力成本低,我们完全有可能将生产设施向那些国家转移。尽管时过境迁,市场环境和法规政策都已经发生了巨大的变化,但是制药巨头们的发家之路,我们依旧可以参考。上世纪六七十年代,欧美的药企全球化时,都是从先进的国家向落后国家扩张,而当前中国的药企也可以到比中国落后的国家扩张,这样可以通过低廉的成本,获取更大的产能,再在适当的条件下把产品卖回中国,甚至卖到美国,以换取更广阔的利润。
积极产业升级,做高端产品
为了甩开竞争,我们必须要进行产业链升级。优化生产工艺和改良生产设备可以节约生产成本,在价格战中获得优势地位,但这只是量变,是局部的。要想完全甩开竞争对手,我们必须做到标准升级、技术升级和产业升级。简单而言,一致性评价可视为一个统一标准的过程,让大家的仿制药产品具有对等性,而仿制药全球化可视为一个标准的升级过程,将中国的标准升级到世界标准,让全世界认可中国的仿制药。尽管如此,标准统一和标准升级尚不足以让一个企业脱颖而出,因为以后仿制药的利润会因价格战而降得很低,要想高利润,我们必须要技术升级,做高端仿制药,比如缓控释制剂,靶向制剂、吸入制剂等等。随着技术的升级,我们需要建立完善技术平台和生产线,能够自主设计和开发创新制剂,最终形成企业的特色,这就是所谓的产业升级。

仿制药领域,成就最大的企业当属Teva,然而Teva并不是单纯的仿制药企业。目前,Teva的销售额大约有45%来自创新药,而55%来自于仿制药。尽管Teva主打仿制药,也是靠仿制药在美国站稳了脚跟,但早在80年代中期,Teva就已经开始布局创新药,先后买下了格拉替雷、雷沙吉兰等产品,2000年之后,又收购了专科药部门、吸入剂部门、以及多个新分子实体和单抗药物,如今创新药已经成为Teva利润的主要来源。除了Teva,最鲜明的例子还有Watson、Mylan、Endo和Valeant,这些企业基本都是靠仿制药起家,但他们在做大之后无时无刻不在向创新药转型,其中最成功的当属Watson,该公司在创立没多久就收购了一个载药技术平台,从事创新制剂的开发,随着企业越做越大,又不断收购新分子实体在研项目,甩出仿制药部门,如今该公司已经成功转型成为创新型企业艾尔建。而Mylan、Endo和Valeant也是各有所长,其中Mylan的Epipan(肾上腺素)可以说是仿创结合的典范,而Endo和Valeant不但在创新制剂领域独树一帜,而创新药也开始斩头露角。
结合以上企业的成功案例,我们不难发现,中国的药企想要成为世界制药巨头,不但要出海,而且要升级和转型。在美国,仿制药市场规模是700亿美元,而新型新型载药系统市场却达1300亿美元,而且布局505b2的企业要比仿制药企业少很多。一个ANDA批文的平均开发费用为250-300万美元,很多企业都能够承受,一个505b2批文的开发成本是数千万美元,部分企业也能够承受,而505b2的最大挑战在于临床试验和产品推广。总之,对于中国药企而言,仿制药出海,仿创结合,做创新制剂,是最省钱、最便捷的发展战略。

国外制药巨头的发家之路已经证明,单独的仿制药支撑不起一个制药巨头,如今Teva的债务泥潭,很大一个原因也就是盲目扩张仿制药规模所致。因此中国的药企想要成为世界制药巨头,必须要创新。仿制药的“盛宴”正在结束,因此我们必须尽快从低端向高端走。从仿制药到高端仿制药,从高端仿制到biosimilar、505b2,再到Mee-Too型新分子实体,最后到First-in-class,一步一个脚印地渐渐过渡。当然了,也有企业想通过创新药的捷径一步登天,但是这捷径犹如“蜀道之难,难于上青天”,并不适合一般中小企业去尝试。
剑走偏锋,精准立项
在7-22事件之前,立项的工作一直不受药企领导待见,在他们眼中,仿制药开发成本很低,根本不需要立项,只要生产线和销售线一致就可以做,很多公司都不愿意成立专门的立项部门,找个制剂或合成研究员写个简单的药物信息介绍就当做立项报告,整个报告不足10页。但7-22事件以后,行情大变,仿制药开发成本大幅升高,老板们不敢再随意立项了,于是开始到处挖专业立项人员。4+7带量采购一出台,很多企业更是慌了,他们开始深刻意识到专业立项的重要性,我身边有多家企业开价年薪30万挖立项专员……
4+7带量采购的威力或许大家已经认识到,笔者在此不再多说。但笔者一开始就说了,FDA、EMA和PMDA批准的新分子实体在中国医药市场中,销售额占比只有50%,改剂型产品更是微不足道,很多产品在中国都没有上市。但这些产品有临床需求,有发展潜力,需要立项的人去把它挖出来。与此同时,很多同靶点的竞争产品(比如DPP-4抑制剂),表面上看几乎差不多,但一深度发掘,你会发现其中别有洞天。首先它们的降糖幅度有强有弱,部分产品可引起心衰,个别产品对肝肾毒性较小,有的产品原料成本低,有的降价空间大……如果没有专业的评估,拍脑袋拍出来的项目,在没有带金销售的助力之后,产品可能因为没有竞争力而批文成为白纸。
要精准立项,公司必须有明确的发展思路。之前参观过一中家小企业,规模虽小,位置虽偏,但他们的发展思路非常清晰,一看他们的产品线就知道背后有“高人”。该公司的目标是做一些用量小、有难度、有不可替代治疗需求的品种,虽然企业小,但人家10年前已获得国际认证,一条原料生产线就两间屋子,几个反应釜,但产值却能上亿。大家都觉得行业的利润正在大幅下滑,人家的营收和利润却在高速上涨。该公司的主打产品就是我之前推荐我公司立项的品种,结果立项报告还没有看就被我公司市场部回绝了,他们认为那只是毛毛雨,而且作为抗溃疡药,在众多质子泵抑制剂面前没有丝毫胜算,但是市场部的人并没有了解到该品种具有抗焦虑的功能,对于特定人群而言具有不可替代的治疗需求。我公司市场部看不上的品种,人家一年卖3个多亿,还是独家品种……说了这么多,我只想证明一点,仿制药是有利可图的,仿制药领域还有很多“美”等待我们去发现。
除了仿制药以后需要精准立项,产业升级以后,做505b2更需要精准立项。相比仿制药,创新制剂开发成本更高,周期更长,风险更大,您需要全面了解临床需求,考虑如何实现与现有药物的差异化,技术能力和资金水平等等。否则项目一经开启,中途流产的损失是无法挽回的。
小结
一致性评价是仿制药替代原研的基础,也是价格战的基础,然而价格战的角逐只是优胜劣汰,不是一竿子打死,只要你的生产成本足够低,质量足够好,商标足够知名,布局清晰,积极应战,完全有可能在激烈的价格战中胜出。
总之,仿制药是依然大有可为,经历了寒冷的冬天,春天还会远吗?但要熬过冬天,您需要适应寒冷,努力地在严寒中活下去。有时候成与败只在瞬间的把握,存与亡就在刹那的平衡,如果你选择了合适的路线,占据了有利的位置,就埋头苦干吧,相信柳暗花明又一村,否则逆水行舟,不进则退。抱怨没有用,我们需要静下来思考,规划我们的发展道路。或许在十年之后,你再回头来看一致性评价,再来看国家带量采购,或许你会觉得往事是那么静美。
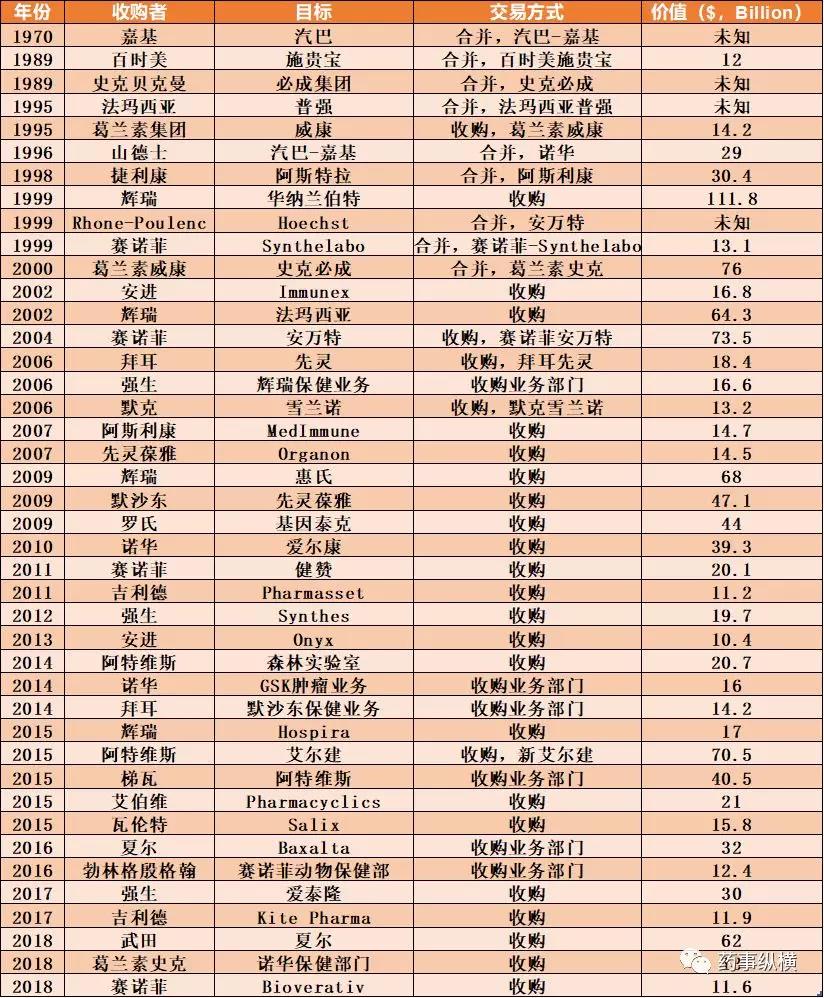
附表,制药领域发生的大规模交易或并购
注意:本文是观点性文章,请读者理想阅读,所有内容只能代表作者本人的看法,如有错误欢迎与作者探讨。文章版权归作者所有,任何人未经作者授权不得私自转载,否则将被追究侵权法律责任。
原创:药事纵横
Copyright Bayeebio Biotech (Shanghai) Co., Ltd. Shanghai 沪ICP备16015574号

